Вакцины COVID, их сравнение и принципы действия
Параллельно разрабатывается много вакцин с разными принципами действия, и возникает резонный вопрос - а какая лучше в конкретном случае? И какие опасности/риски. Учитывая, что цифры эффективности у всех высокие, но при этом разработку никто не бросает. Хотя для бизнеса (в т.ч. фармацевтического) ранняя остановка это распространённая стратегия, учитывая, что каждый следующий этап клинических испытаний намного дороже предыдущего.

Какие параметры вакцин важны?
Про имуногенность слышали, наверное, все, это способность вакцины вызывать наработку специфического иммунитета, т.е. направленного против конкретного агента. Некоторые параметры имуногенности (например титр антител) легко характеризуются одним числом, поэтому очень велик искус использовать её как универсальную метрику "хорошести" вакцины, вроде количества мегапикселей в камере.
Другие параметры (клеточный иммунитет, тканевой) сложно измеряются в лабораторных условиях + нет общепринятых скалярных мер их величин, поэтому эти вопросы затрагивают реже.
Величина имуногенности не говорит о том, насколько эффективно вакцина будет защищать от болезни, в дело вступает специфичность. У этой величины нет красивого скалярного выражения, но интуитивно смысл понятен - после "настройки" вакциной с высокой специфичностью иммунитет будет атаковать возбудитель, и ничего более, чего бы он не атаковал до вакцинации.
Конкретно в случае COVID этот параметр очень важен, так как в основном люди погибают не от поражения самим вирусом, а от friendly-fire собственного иммунитета, аутоимунной реакции. И вакцина, гипотетически, может усугубить ситуацию, при сочетании определённых неблагоприятных факторов. Но это очень активно отрицается. Задачей статьи не ставится сражение против (или за) теорий заговора, поэтому идём дальше.
Помимо этого ещё есть эффективная длительность, как долго, в среднем, шанс заболеть вакцинированного человека существенного меньше, чем невакцинированного. Само определение намекает на то, что величина очень чувствительна к методу определения, что считать существенно. Более того, даже в вопросе - что считать "заболеть", касаемо COVID, нет однозначности. Получить позитивный PCR тест, испытать лёгкие симптомы, испытать тяжёлые симптомы, быть заразным для окружающих, появление антител в крови, потребность в госпитализации ? В зависимости от задачи, научной или политической, смысл (и значение) этих параметров несколько меняется.
Отсюда и существенные разночтения в определении efficacy (отношение не-заболевших в тестовой группе к общему числу людей) и effectiveness (тоже самое, но уже вне клинического испытания) и достаточно малый уровень доверия к таким параметрам, даже у специалистов.
Именно поэтому даже не специалистам не помешает копнуть чуть-чуть глубже чтобы принимать взвешенные решения, влияющие на здоровье себя и близких.
Какие вакцины бывают? (противовирусные)
Живая
Состоит из ослабленных возбудителей заболевания. Ослабляют, как правило, воздействием радиации и/или химических агентов, обычно сильных мутагенов. Вирус остается "живой", т.е. способен к внедрению в клетку, но не способен размножаться (по крайней мере эффективно)
Иммуногенность: максимальная
Живые возбудители это аналог тренировки боем, активирующий абсолютно все релевантные части имунной системы (и вспомогательных систем), таким образом обеспечивая максимально возможную имуногенность (при текущем уровне развития науки).
Селективность: высокая
Выработка иммунитета это довольно сложная штука, начиная с системы презентации антигенов и заканчивая кодированием их признаков в генетическом материале клетки. С полноценным возбудителем (где есть и белковая оболочка, и генетический материал, и активные попытки противостоять фагоцитозу) все системы работают в максимально эффективных условиях. Все эти процессы довольно слабо изучены, поэтому наиболее надёжный подход - меньше вмешиваться.
Длительность: большая
Максимально повторяет естественный ход заболевания, просто "подыгрывая" с ослабленным возбудителем. Соответственно иммунитет получается максимально эффективным.
Опасность для реципиента: максимальная
При небольшом нарушении технологии получается непреднамеренное заражение человека, причём чистым возбудителем смертельно опасного заболевания. В массовом производстве (даже лекарств) нарушения технологии неизбежны, а даже один умерший таким образом человек - это очень громкое судебное дело и огромные проблемы. Помимо этого, вместе с целевым вирусом при ошибках экстракции (они распространены) могут попасть сопутствующие вирусы, что не добавляет безопасности.
Доступность: Минимальная
Массовая культивация вирусов это сложный процесс, а когда вирус смертельно опасен для человека - вся техническая линия должна быть оборудована по уровню FP-3 или даже FP-4 лаборатории, что очень дорого, а развернуть быстро такие мощности просто невозможно. Живые патогены невероятно тяжело перевозить, невзирая на их уровень "ослабленности". Хранение при сверхнизких (< 70 C) температурах.
Дополнительно: исторически первый класс вакцин, в производстве и разработке не требует rocket science и прочих чудес молекулярной биологии.
Инактивированная
Состоит из убитых патогенов. Убивают обычно тем же, чем и ослабляют, только большим количеством. Вирус получается мёртвый, но может быть захвачен клетками иммунной системы и в дальнейшем обрабатываться почти как живой.
Иммуногенность: высокая
В материале присутствуют все части вирусов, однако зачастую с нарушенной целостностью, и часто химически повреждённые (в основном окисленные). Они тоже вызывают иммунный отклик, однако не такой согласованный, как в случае живого патогена.
Селективность: средняя
В случае вирусов гибель патогена эквивалентна его разрушению, поэтому и белки, и наследственная информация доходят в повреждённом (причём к каждой клетке немного по разному) виде, а значит и отклик на них будет достаточно "широким". На практике это выражается повышенной вероятностью аутоиммунных реакций и необходимостью сравнительно частых ревакцинаций.
Длительность: средняя
В иммунологии действует эмпирическое правило, что чем более специфична имунная реакция - тем дольше она сохраняется. Из-за сравнительно низкой специфичности могут потребоваться сравнительно частые ревакцинации.
Опасность для реципиента: большая
В случае отсутствия совсем грубых нарушений техпроцесса шанс заболеть инфекцией мал. Вместе с тем, риск аутоиммунных реакций ещё выше, чем у живой вакцины. Плюс возможны неспецифичные реакции на "осколки" мёртвых вирусов, например свободную РНК в плазме крови + аллергические реакции.
Доступность: низкая
Массовая культивация так же проблематична, как и для живой вакцины. Транспортировка ощутимо легче, но всё равно ограничен специальными регламентами. Может быть произведён вариант, при котором вакцина хранится при низких (~ -2-10 C) температурах.
Примеры: Sinovac (CN), Valneva (FR), вакцина центра Чумакова (RU)
Белковая
Состоит из рекомбинантного белка (или белков) патогена. Рекомбинантный - синтезируется не патогеном, а другим организмом (обычно это дрожжи), в которые нужные гены введены искусственно.
Иммуногенность: средняя
Вакцина содержит только релевантные (по мнению исследователей) белки, обычно один белок. В случае COVID это, зачастую, белок "шипа", которым вирус связывается с клеткой. Капсид вирусов, вспомогательных белков, РНК материала нет, поэтому такая вакцина действует только на антиген-презентирующую систему.
Селективность: высокая
До всех клеток доходит один и тот же белок, с незначительными модификациями, идентичными натуральным (встречающихся в реальных вирусах). С т.з. data science это можно было бы назвать хорошим репрезентативным dataset (правда без контрпримеров).
Длительность: высокая
См. предыдущее описание, высокая селективность ~> высокая длительность.
Опасность для реципиента: низкая
Основной риск это высокоспецифичная аллергическая реакция, они очень редкие.
Доступность: средняя
Технические процессы культивации рекомбинантных белков сравнительно хорошо разработаны, после решения научных задач (введение гена, совместимость, обеспечение необходимой конформации, разработки методов экстракции) технология хорошо масштабируется. В то же время научная часть наиболее сложная (сравнимо с другими вакцинами). Хранение возможно при небольшом минусе, логистика сравнительно простая.
Примеры: Novavax (US), частично ЭпиВакКорона (RU)
Генетическая
Вносит в клетки организма генетический материал, необходимый для синтеза иммуногенного белка вируса (в случае COVID это модифицированный белок шипа). Белок презентуется антиген-презентирующей системой и вызывает иммунный отклик. Есть несколько подвидов, в зависимости от способа доставки генетического материала в клетку:
-
Векторный - целевой ген доставляется при помощи генетического вектора, обычно модифицированного безвредного вируса
-
мРНК - доставляется уже собранная матричная РНК, на основе которой синтезируется целевой белок.
Несмотря на отличия в механизме итоговые параметры очень схожи, поэтому объединены в один класс.
Иммуногенность: средняя
Нюанс в том, что презентированный белок вируса, и идентичный натуральному, синтезированный клеткой на основе генетической вакцины - разные. Эмпирически определили, что иммунный ответ вызывает только модифицированный белок шипа, а не тот, какой в вирусе. Это связано с тем, что цепочки пост-трансляционных модификаций для вирусного белка, и белка, синтезированного вакциной - разные. Насколько иммунитет, вызванный натуральным белком, отличается от иммунитета, вызванного модифицированным - неясно, конкретная причина отличий тоже.
Селективность: средняя
Вакцина, как правило, несёт на себе ген, кодирующий один белок, а не их вариацию (как было бы в белковом варианте). Более того, вариация в структуре не идентично натуральным вариациям данного белка, из-за пост-трансляционных модификаций.
Длительность: средняя
См. предыдущее описание, высокая селективность ~> высокая длительность.
Опасность для реципиента: средняя
Наиболее понятный риск это высокоспецифичная аллергическая реакция, они достаточно редкие. Тем не менее, такая вакцина уже является генной терапией (первой массово применяемой), а в целом, что происходит на таком "низком", молекулярно-биологическом уровне очень слабо изучено. Особенно в случаях со-заражения другим вирусом, который несёт на себе обратную транскриптазу. И какие будут последствия экспрессии изменённого белка через полную цепочку превращений (в зависимости от того, начал ли белок синтезироваться с транскрипции, или сразу с трансляции, список модификаций будет разным, из-за пост-транскрипционных модификаций).
Недавно стало известно, что COVID иногда может встраивать фрагменты своего кода в генетический материал человека, без применения обратной транскриптазы, как - непонятно. Как это может взаимодействовать с вакцинами - тоже. Хотя в многих научно-популярных статьях утверждается, что mRNA Vaccines Are Not Going To Affect Your DNA, но я бы назвал бы это очень смелым утверждением, учитывая уровень непонимания того, что происходит. Более того, по личному опыту я замечаю, чем более человек разбирается в молекулярной биологии, тем менее он уверен в том, как что-то работает и категоричен в утверждениях.
Доступность: высокая
Производство сравнительно просто, хорошо масштабируется и безопасно. В зависимости от технологии производства для хранения могут требоваться как и низкие (-70 C, в случае мРНК вакцины) так и обычные (-2-5 С, для векторных вакцин) температуры.
Примеры: Pfizer/NTech (GE+US), AstraZeneca (UK), Moderna (US)
Что не так с этим типом?
Любая технология имеет плюсы и минусы. Взяв любой вопрос, даже не из медицины, например импульсные блоки питания, или использование крахмала в выпечке, или электромобили - всегда будут плюсы и минусы. В медицине так же - антибиотикотерапия, стероиды, гормоны - всегда есть за и против, в зависимости от ситуации. Но с применением генетических вакцин ситуация несколько иная, и в академических и в популярных статьях. Минусов просто нет. Во всяком случае автору статьи не удалось найти ничего серьёзного, только безусловные плюсы (с аккуратным замечанием, что это очень новый тип, и всякое может быть), ну и несколько мракобесов, тезисы которых опровергаются. Как минимум это подозрительно. Вместе с этим работает активная пропаганда среди населения и учёных, которая иногда вызывает обратный эффект.
Ажиотаж частично объясняется тем, что этот тип изучается более 40 лет, вложены большие деньги, но ни единой работающий, массово применяемой мРНК вакцины (не считая COVID) на данный момент нет. А гранты выделены, очень много статей написано, и естественно что исследователи защищают свои труды. Факт, что первое применение фундаментально нового типа вакцин совпадает с невероятной срочностью тоже не внушает автору доверия. Такой скептицизм разделяют и знакомые иммунологи, отлично знакомые и с расширенными отчётами испытаний и участвующие в принятии релевантных политических решений.
Сводная таблица

Типы вакцин расположены в хронологическом порядке. Легко заметить, что оптимизировался в основном параметр доступности. Основной задачей массовой вакцинации является не защита каждого человека от инфекции, а достижение невозможности её неконтролируемого распространения. Для этого определённая часть населения (в зависимости от типа вируса 20-70%) населения должна иметь иммунитет.
А какие вакцины уже есть ?
Все допущенные до клинического применения (в СНГ, ЕС И США) вакцины принадлежат к последнему классу - генетических вакцин: Спутник V, AstraZeneca, Pfizer, Moderna и остальные. Хотя конечный эффект у всех одинаковый (синтез, презентация белка и активация специфического иммунитета), механизмы несколько отличны.
Структура у всех общая - целевой ген (везде одинаковый) + переносчик информации (вектор или уже синтезированная мРНК) + упаковка вируса (тоже разная).
Pfizer/NTech использует мРНК, инкапсулированную в липидные везикулы, которые защищают РНК (оно исключительно хрупкое и химически неустойчивое) до попадания в клетку.
Спутник V использует аденовирус человека, большая часть остальных векторных вакцин - обезьяны. Теоретически аденовирус человека должен иметь большее сродство и работать лучше, но с другой стороны - если человек уже болел этим аденовирусом, эффективность будет близка к нулевой. С обезьяньим такого не получится.
Ситуации win-win нет, высокую эффективность демонстрирует вакцина Pfizer, но при этом требует хранения при температура -70. AstraZeneca может хранится при +2-8 но по результатам клинических исследований имеет эффективность 70% (против 95% у Pfizer). Впрочем, впоследствии результаты были скорректированы, и сейчас превышают 90% для всех типов вакцин.
Белковые на момент написания статьи находятся на 3м этапе клинических испытаний. Живые используются только для небольших экспериментальных групп и для массового применения не подходят. Инактивированные сложно применять для широких групп, тем не менее Китай решил технические проблемы и проводит массовую вакцинацию.
Помимо вышеперечисленных вакцин существует сыворотка ЭпиВакКорона, которая, строго говоря, вакциной не является (однако как вакцина рекламируется и освещается в СМИ). Она не вызывает устойчивую наработку специфического иммунитета, и содержит короткие фрагменты вируса, вызывающие немедленный иммунный отклик. Тип сравнительно редкий и исследований таких вакцин проведено мало.
Выводы
В идеальном мире государство заботится о здоровье каждого члена общества. В реальном, к сожалению, спасение утопающих это дело самих утопающих. Медицина в РФ куда хуже, чем это по советской инерции кажется.
Протоколы лечения мягко говоря неадекватны (и, естественно, ортогональны международному опыту), и наивно полагать, что с вакцинацией уж точно лучше. Вакцинироваться ли, какой вакциной, какие риски - решать каждому. Но решать лучше осведомлённо, и не ориентироваться на популярность/магическое число эффективности.
По мнению автора имеет смысл подождать белковых вакцин, если вы не находитесь в группе риска. Это минимизирует шанс долгосрочных последствий / ваше участие в широкомасштабном тестировании нового типа вакцин. Я знаком с тем, как происходят клинические испытания, как анализируются результаты и насколько они достоверны/полны - честно говоря, не очень.
Люди, имеющие бронхиальную астму, не относятся к группе риска. Даже наоборот, шанс заболеть (и тяжело заболеть) COVID'ом для них намного ниже, чем в среднем по популяции.
P.S. Автор по роду деятельности учёный в далёкой от СНГ стране, биофизик, занимается теорией сложных систем и её приложением, в частности, к клеточному иммунитету/механизму дифференцировки стволовых клеток. В прошлом работал в Novartis аналитиком уже проведённых научных исследований, анализируя их достоверность и потенциальную ценность для бизнеса.
Статья ниже была опубликована в конце осени прошлого года, возможно с тех пор что-то изменилось, но не кардинально.
Сравнение российской «Спутник V» и BNT162b2 от Pfizer
Девятого ноября американский фармацевтический гигант — Pfizer объявил об успешном завершении третьей фазы клинических испытаний вакцины BNT162b2 против нового коронавируса, и полученных результатах в 90% эффективности.
Любопытно, что спустя всего 2 дня после пресс-релиза Pfizer, на сайте российской вакцины «Спутник V» (названной в честь прототипа корабля, отправившего первого человека в космос) было опубликовано сообщение о её 92% эффективности.
В этой статье мы сравним эти две вакцины, разберем принцип их работы, а также поговорим о том, почему мировое научное сообщество довольно критически отнеслось к российской разработке.
Содержание:
-
Сравнение предварительных результатов третьей фазы
-
Как появляется иммунитет к вирусам
-
Типы современных вакцин
-
Как работает вакцина «Спутник V»
-
В чём отличия вакцины от Pfizer
-
Итоги
Сравнение предварительных результатов третьей фазы клинических испытаний
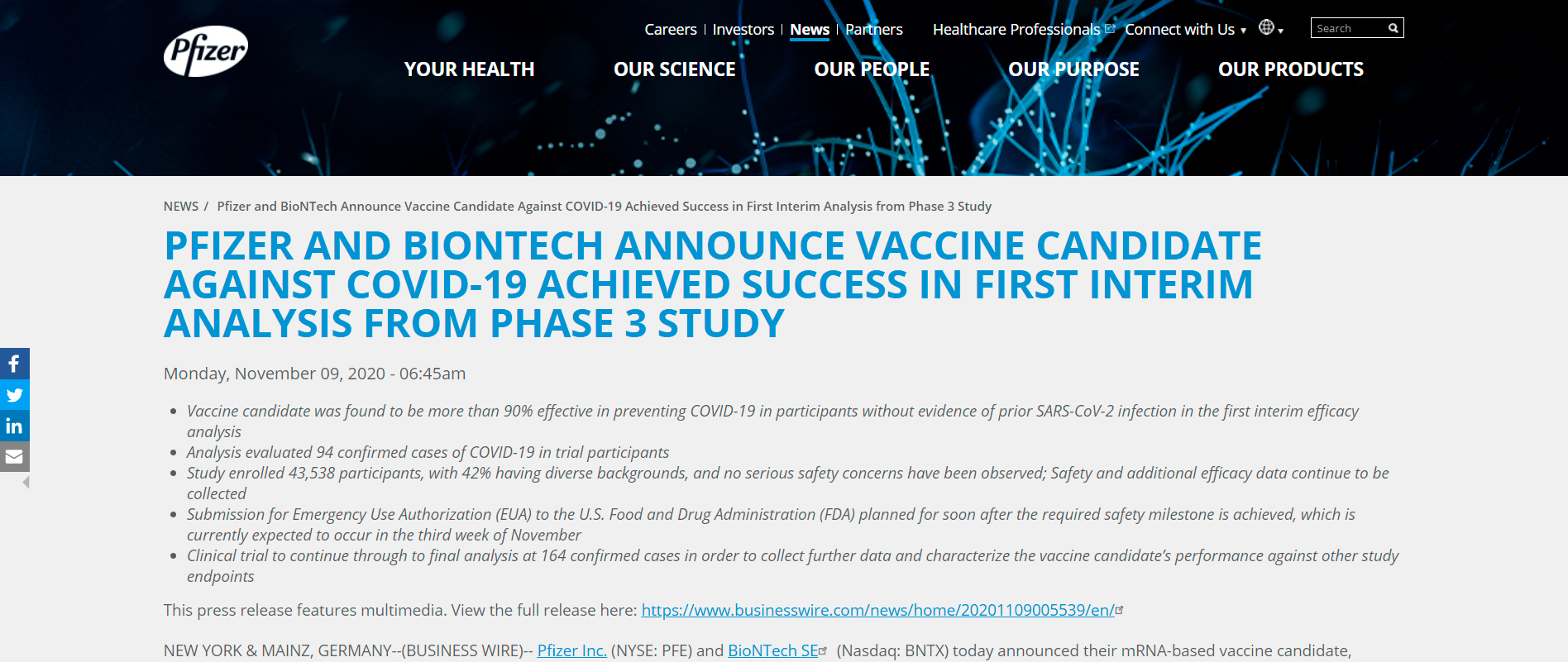
Предварительные данные, полученные по результатам двойного слепого рандомизированного плацебо-контролируемого клинического исследования вакцины BNT162b2, разработанной совместно Pfizer и BioNTech, проведенного с участием более 43 тысяч человек, показали 90% результативность вакцины.
Это значит, что из 94 зарегистрированных случаев COVID-19 среди всех участников исследования, в группе получивших плацебо, было на 90% больше случаев этого заболевания, чем в группе получивших две дозы вакцины. Эти результаты были получены на момент прохождения первой контрольной точки — то есть 7 дней после вакцинации. А всего в анализ было включено 38 тысяч участников. В настоящее время продолжается сбор данных для анализа после прохождения второй контрольной точки — 14 дней, после чего будут опубликованы окончательные результаты [1].
 Источник: https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-vaccine-candidate-against
Источник: https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-vaccine-candidate-against
Из сообщения опубликованного на сайте российской вакцины «Спутник V» её эффективность составила 92% , установленной в результате анализа данных о заболеваемости COVID-19 среди 16 тысяч добровольцев по прошествии 21 дня после получения ими первой дозы отечественной вакцины, при этом в анализ были включены всего около 20 случаев заражения [2].
Первоначально основная причина критики в адрес «Спутник V» состояла в том, что регистрация препарата была проведена до окончания 3-й фазы клинических испытаний [3], но похоже, что и публикация последних данных не слишком уменьшила количество скептиков, поскольку 20 зарегистрированных случаев заболевания не позволяют говорить о достаточной надежности выводов. Уверенности в результатах также не прибавляет и тот факт, что протоколы российского исследования пока не были раскрыты [4].
 Источник: https://sputnikvaccine.com/rus/newsroom/pressreleases/effektivnost-vaktsiny-sputnik-v-protiv-koronavirusa-sostavila-92-v-khode-pervogo-promezhutochnogo-an/
Источник: https://sputnikvaccine.com/rus/newsroom/pressreleases/effektivnost-vaktsiny-sputnik-v-protiv-koronavirusa-sostavila-92-v-khode-pervogo-promezhutochnogo-an/
Но давайте отвлечемся от политической подоплеки и сравним характеристики этих двух вакцин, чтобы понять насколько они отличаются. Но для начала в общих чертах вспомним то, как работает адаптивный иммунитет, который эти вакцины должны "создавать" .
Как появляется иммунитет к вирусам
Поскольку вирусы очень быстро мутируют система адаптивного иммунитета фактически не знает, как будет выглядеть новый захватчик и поэтому в организме всегда должно существовать очень много иммунных клеток с разными вариантами рецепторов — антител (всего возможно порядка сотен миллиардов вариантов) [5].
Эти клетки называются лимфоцитами, поскольку концентрируются в лимфоузлах в которые доставляются, как в полицейский участок, специальными патрульными — дендритными клетками или фагоцитами разные подозрительные нарушители. Эти патрульные сканируют каждую клеточку и уголок организма с расчетом на то, что если какой-то фрагмент чужеродного белка — антиген попадёт в организм, то рано или поздно какой-то из миллиардов рецепторов лимфоцитов распознает его и сможет с ним связаться.
Существует два типа лимфоцитов: B-лимфоциты (от Bone marrow — костный мозг ) и Т-лимфоциты (от Thymus — вилочковая железа). И после того, как рецептор В-лимфоцита свяжется с антигеном, прежде чем запустить иммунный ответ необходимо убедится, что антиген — это точно что-то инородное ведь иначе могут пострадать собственные здоровые клетки. Поэтому В-клетка приносит (презентирует) фрагменты найденного антигена на подтверждение Т-клетке (Т-хэлперу), каждая из которых проходит отрицательный отбор в специальном и очень важном органе иммунитета — тимусе, после чего она гарантировано не будет способна реагировать на белки клеток собственного организма.
Если В-клетка находит Т-клетку, которая способна распознать антиген, то сомнений не остается — в организм попал чужеродный захватчик и запускается иммунный ответ, в процессе которого В-клетка с тем типом рецептора, который распознал захватчика, начинает активно клонировать сама себя. Часть клонов профилируются в так называемые плазматические В-клетки и начинают производить и распространять вокруг себя множество копий внешней части своего рецептора, который благодаря способности связываться с антигеном может например облепить вирус и деактивировать его, а также служит маячком, который указывает цель для остальных клеток, участвующих в уничтожении патогенов во время иммунного ответа.
По количеству рецепторов — антител, соответствующих определенному типу вируса и плавающих в крови, определяют выработался ли у человека иммунитет к данному штамму или нет.
Эта же схема на видео:
Типы вакцин
Вся проблема в том, что до встречи антигена с клетками иммунитета обладающими подходящими для него рецепторами необходимо время, за которое вирус успеет нанести достаточно большой вред организму. Противовирусная вакцина помогает создать иммунитет без ущерба для здоровья за счет того, что знакомит иммунные клетки либо с ослабленным вирусом, либо с безвредными частями вируса. Существующие на данный момент вакцины можно разделить на три типа:
-
Цельнопатогенные — вакцины, содержащие ослабленные — аттенуированные или убитые — инактивированные вирусы. Исторически самые первые вакцины, но применяются и сейчас, одним из современных примеров является комбинированная вакцина MMR — против кори, паротита и краснухи. К сожалению ослабленные версии патогенов могут вызывать иммунный ответ далеко не во всех случаях.
-
Субъединичные — содержащие только определенные субъединицы — фрагмент или белок вируса, считаются более безопасными, но требуют введения дополнительных веществ адьювантов — веществ, способных связывать антиген из вакцины, благодаря чему он может дольше задерживаться в организме и сильнее привлекающих внимание иммунной системы [6].
-
Вакцины на основе нуклеиновых кислот — наиболее современные решения, являющиеся продуктом развития биотехнологий и генной инженерии. Вакцины этого типа также решают задачу натаскивания иммунитета на определенный белок вируса, но уже не за счет прямой доставки белка в организм, а за счет процесса более похожего на реальное заражение — доставки внутрь клетки генетического материала, который заставляет клетку производить нужные белковые запчасти вируса, на которые затем будет развиваться иммунный ответ и вырабатываться антитела [7].
Как работает вакцина «Спутник V»
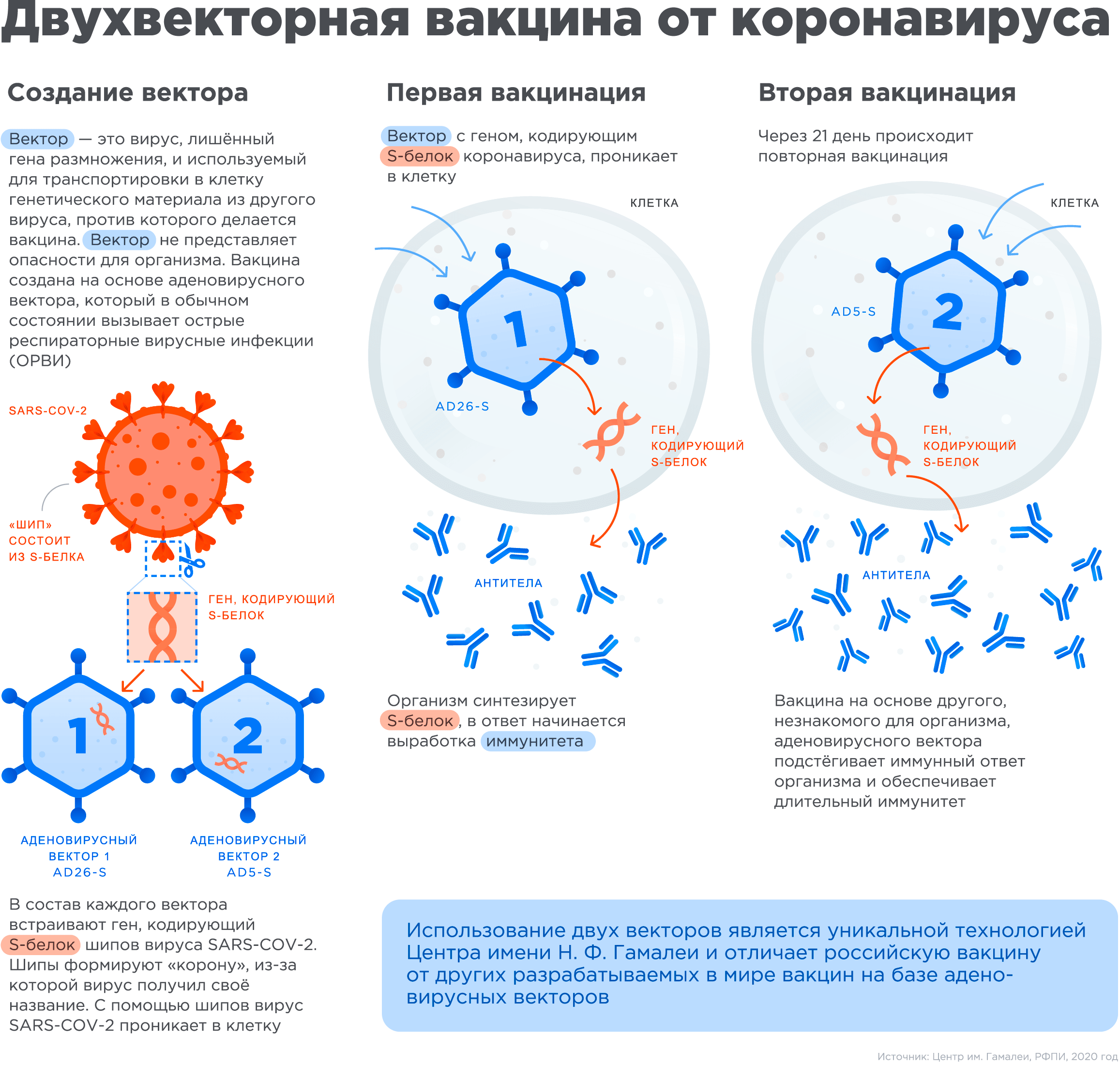
Российскую вакцину «ГАМ-Ковид-Вак» или «Спутник V» можно отнести к типу химерных вакцин на основе нуклеиновых кислот. Химерная она поскольку состоит из нескольких модифицированных частей, взятых от разных вирусов: оболочки состоящей из так называемого вектора — вируса-доставщика, лишенного способности размножаться, но способного проникать внутрь клеток, и встроенного в этот вирус гена, который кодирует один из белков патогенного опасного вируса.
Вакцина «Спутник V», разработанная в Национальном исследовательском центре эпидемиологии и микробиологии имени Н. Ф. Гамалеи. содержит вектор созданный на основе двух различных вариантов аденовируса человека со встроенным в них геном коронавируса Sars-COV-2, который кодирует тот самый белок шипа (spike protein), с помощью которого вирус крепится к поверхности клеток.
Механизм действия вакцины следующий: попадая в организм химерный вирус из вакцины заражает клетки, в результате чего они начинают производить белки шипов коронавируса, иммунные клетки понимают, что происходит что-то неладное и детектируют чужеродный белок, презентируют его Т-клеткам, что в результате приводит к иммунному ответу и выработке специфических антител [8].
 Источник: https://www.gamaleya.org/research/vaktsina-protiv-covid-19/
Источник: https://www.gamaleya.org/research/vaktsina-protiv-covid-19/
В чём отличия вакцины от Pfizer
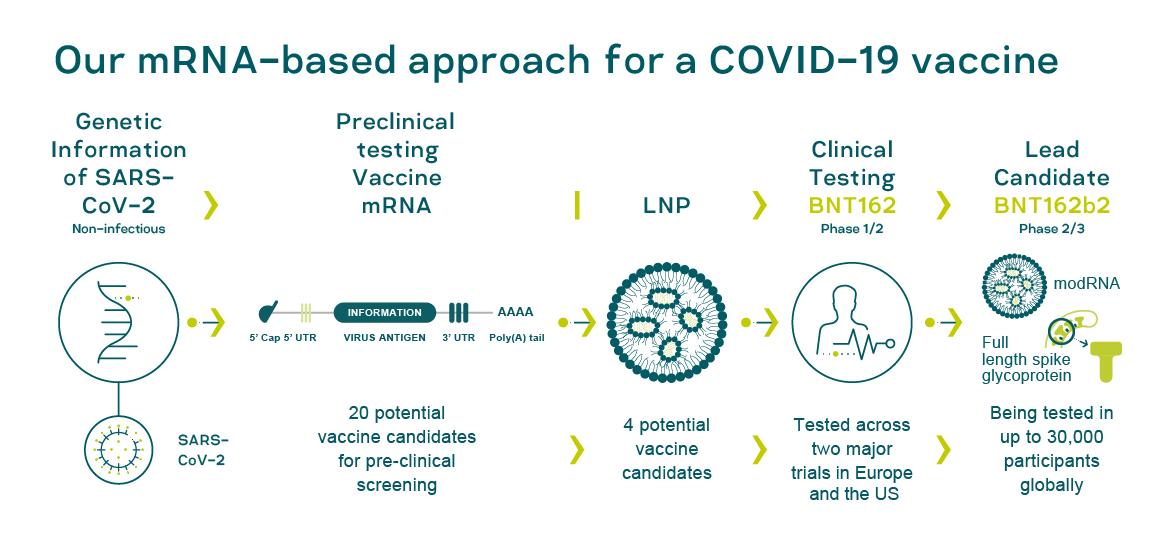
Вакцина BNT162b2 разработанная Pfizer и BioNTech также относится к типу вакцин на основе нуклеиновых кислот, её целью также является “знакомство” иммунной системы с белком шипа коронавируса и эта вакцина также как «Спутник V» использует клетки организма пациента для синтеза этого белка.
Основные различия состоят в способе доставки фрагмента генетического материала вируса внутрь клетки. Вместо вирусного вектора BioNTech использует липидные наночастицы, или попросту жировые пузырьки, внутри которых находится информационная или так называемая матричная РНК (мРНК) содержащая генетическую информацию, по которой внутри клетки затем собирается белок того самого шипа [9].
Сама BioNTech специализируется на разработке методов терапии с использованием мРНК. Но поскольку коронавирус Sars-COV-2 относится к типу вирусов которые в качестве генома используют как раз мРНК, то вакцина «Спутник V» содержащая ген вируса шипа и вакцина BNT162b2 на основе мРНК — имеют в своем составе один и тот же тип генетической информации и принципиальной разницы тут тоже нету.
Итоги
Качественных отличий между вакцинами BNT162b2 и «Спутник V» не так уж и много, за исключением способа доставки генетического материала для производства антигена внутрь клетки.
Основные различия существуют в позиционировании и подходе к испытанию и регистрации вакцины. И во многом именно это вызывает критику и сомнения в достоверности данных о безопасности и эффективности российской вакцины «Спутник V» [3] [4].
Примечание:
Изначально последний абзац содержал личное мнение автора статьи, но, как справедливо заметили в комментариях это недопустимо при публикации обзора, поэтому он был вынесен отдельный спойлер.
Личное мнение автора
Считаю, что руководящим принципом при разработке вакцины должна быть безопасность и эффективность, обеспечивающая защиту здоровья людей, а подход к вакцинации при котором даже своим названием препарат выдает в организаторах испытаний желание быть первыми в некоторой «гонке вооружений», а протоколы исследований остаются не раскрытыми на момент публикации данных, может свести на нет доверие к вакцине и значительно уменьшить количество людей желающих пройти вакцинацию.
Ссылки на источники указанные в тексте
1 https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-vaccine-candidate-against
2 https://sputnikvaccine.com/rus/newsroom/pressreleases/effektivnost-vaktsiny-sputnik-v-protiv-koronavirusa-sostavila-92-v-khode-pervogo-promezhutochnogo-an/
3 https://www.nature.com/articles/d41586-020-02386-2
4 https://www.nature.com/articles/d41586-020-03209-0
5 https://www.ncbi.nlm.nih.gov/books/NBK27140/#A449 6 https://www.niaid.nih.gov/research/vaccine-adjuvants
7 https://www.niaid.nih.gov/research/vaccine-types
8 https://www.gamaleya.org/research/vaktsina-protiv-covid-19/
9 https://biontech.de/covid-19








Комментарии
От Pfizer люди дохнут, а от Спутника ни одного смертельного случая!
От работы кони дохнут.
А от безделья ни одного смертельного случая.
Так потому ты жив и здоров?
Какой вы глупый. Российской вакциной вакцинировали не более миллиона человек, а этой уже гораздо больше. Да и вообще вы не думаете, что Россия просто не публикует эти данные? И если бы вы немного больше ознакомились с данными о смертях, то узнали кто конкретно умер
Факты в студию . Откуда тогда у тебя такие данные ?
...кто сейчас ждет публикации, весь интернет бы "взорвали", если бы что-то пошло не так...
а ты очкошник партизан карутулеб целыми днями на стене в комментах, у тебя жизнь то есть какая-то вообще?
Жизнь каждого человека важна! или ты хотел услышать что-то другое?
Священная вода от батюшки из церкви тоже помогает от вируса.
и веришь,что ни одного-наивный.
Дело в том, что пфайзер транспортируется при -70, что крайне тяжело соблюсти и даже если сама вакцина будет "неплохой" в чем тоже сомневаюсь, то вероятность того, что будут нарушены правила транспортировки очень велики, вряд ли ответственные за хранение и транспортировку возьмут вину на себя, халатность медработников на каждом шагу, проще эту вакцину использовать втихаря а потом будете думать откуда такие последствия.
Спутник первоначально транспортировался при -18, а теперь выяснили, что и +2 +4 подходит для транспортировки и вакцина не теряет свои свойства. Вот даже хотя бы исходя из этого я больше доверяю российской вакцине.
Да какая разница, какой вакцине Вы верите, а какой нет. Дело в том, что тема вакцинации политизирована донельзя, плюс ко всему, дико популярна у журналюг, потому как имеет статус "жареной".
Соответственно, никто не даст Вам объективной и гаранированный инфы о том, какая вакцина лучше. Сегодня многие сходятся на том, что Спутник лучше мериканской, а завтра будет наоборот.
Отправить комментарий